 Prawie wszystkie wycofania produktów medycznych są dobrowolnie wydawane przez firmy, a nie nakazane przez FDA. wavebreakmedia / Shutterstock.com
Prawie wszystkie wycofania produktów medycznych są dobrowolnie wydawane przez firmy, a nie nakazane przez FDA. wavebreakmedia / Shutterstock.com
Z skażenie lekiem na ciśnienie krwi walsartanem które naraziły tysiące pacjentów na rakotwórcze zanieczyszczenia, masywne przywołanie rozrusznika podjęte w celu naprawienia niebezpiecznego błędu oprogramowania w pół miliona urządzeń kardiologicznych, problemy z jakością produktów opieki zdrowotnej są zawsze obecne i bardzo niebezpieczne.
W rzeczywistości, wycofywanie produktów medycznych – w szczególności ciężkie, zagrażające życiu lek farmaceutyczny i Urządzenie medyczne przypomina – mieć stale wzrastał w ciągu ostatniej dekady.
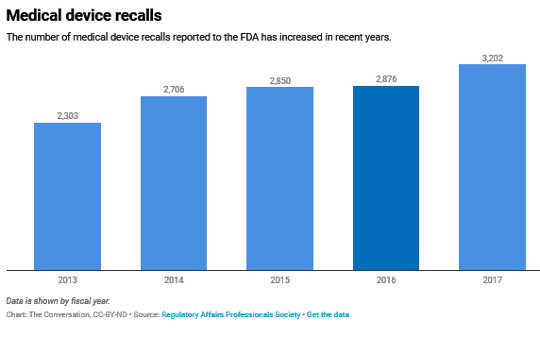
Nie jest niespodzianką, że wycofania produktów medycznych są zdarzeniami powszechnie negatywnymi. Firmy starają się ich unikać, klienci nimi gardzą, a federalni regulatorzy są zmuszeni je nadzorować. Są związane z miliony dolarów niechcianych kosztów korporacyjnych i spadków cen akcji, wraz ze znacznym i kosztownym nadzorem regulacyjnym każdego roku.
Spędziłem ponad dekadę jako kierownik produkcji w firmach zajmujących się urządzeniami medycznymi z listy Fortune 500, podejmując dziesiątki decyzji dotyczących wycofania i zaleceń – niektóre dobre decyzje, inne mniej – a przez ostatnie kilka lat naukowiec akademicki zaangażowany wyłącznie w przypomnienie badań. Moi koledzy i ja dokładnie przestudiowaliśmy, co powoduje defekty, które prowadzą do wycofania, a także uprzedzenia, które istnieją w decyzjach menedżerów o wycofaniu.
Nadmierna konkurencja kosztowa
Na rynkach kapitalistycznych konkurencja jest postrzegana jako siła dobra. Konkurencja może obniżyć koszty, zwiększyć dostęp i, miejmy nadzieję, poprawić jakość. Te korzyści przypisywane konkurencji wyjaśniają stałe wezwanie do większego dostępu do leków generycznych.
Chociaż rzadko jest to omawiane w zatłoczonej debacie na temat kosztów opieki zdrowotnej, niekończące się wołanie o tańsze leki generyczne i bardziej przystępną opiekę może mieć wadę.
Badania przeprowadzone z kolegami Rachna Shah z University of Minnesota i Kaitlin Wowak z Uniwersytetu Notre Dame pokazuje, że intensywna konkurencja leków generycznych prowadzi do wzrostu liczby przypadków wycofania leków z produkcji, które są bardzo niebezpieczne.
Nasze badanie, opublikowanym w maju 2018 r., pokazuje, że konkurencja leków generycznych powoduje, że firmy ograniczają swoje praktyki kontroli jakości produkcji, starając się zachować rentowność, co prowadzi do wzrostu liczby zagrażających życiu wad leków wymagających wycofania.
Jednym z wielu przykładów tego typu problemów jest niedawny Przywołanie atorwastatyny Ranbaxy. Błędy w systemie kontroli jakości produkcji doprowadziły do zanieczyszczenia niezatwierdzonymi surowcami. Producent leku generycznego zgodził się na: Grzywna rządowa w wysokości 500 mln USD.
 Wycofania produktów medycznych z rynku wzrosły w ciągu ostatniej dekady. Atsushi Hirao/shutterstock.com
Wycofania produktów medycznych z rynku wzrosły w ciągu ostatniej dekady. Atsushi Hirao/shutterstock.com
Znajomi inspektorzy FDA
Jednym ze sposobów na złagodzenie takich niefortunnych skutków ubocznych konkurencji jest zastosowanie przepisów amerykańskiej Agencji ds. Żywności i Leków oraz praktyk kontroli jakości.
Kluczowym narzędziem wykorzystywanym przez FDA do poprawy jakości produktów są inspekcje zakładów. Inspektorzy FDA odwiedzają zakłady w dwuletnim cyklu rotacyjnym. Te oceny wyników inspekcji mogą być wczesnym ostrzeżeniem o przyszłych wycofaniach z zakładu – jeśli inspektor FDA dokładnie uchwyci odpowiednie ryzyko.
W badaniu 2017 z Szachem i Enno Siemsen z Uniwersytetu Wisconsin-Madison, odkryliśmy, że oceny wyników zakładów FDA można wykorzystać do przewidywania przyszłych wycofań produktów wytwarzanych w tym zakładzie. Jednak dzieje się tak tylko wtedy, gdy inspektor nigdy wcześniej nie odwiedził zakładu.
Nadmierna znajomość między inspektorami FDA a kierownictwem zakładu osłabia dokładność ocen, nawet po zaledwie jednej powtórnej inspekcji. Inspektorzy stają się zadowoleni, gdy lepiej zapoznają się z zakładem i ludźmi, którzy w nim pracują.
Odkryliśmy, że zmiana inspektora na każdą inspekcję zakładu przez FDA znacznie poprawiłaby wartość tych inspekcji i kosztowałaby FDA mniej niż 1 milion dolarów rocznie. Niska cena za bezpieczeństwo urządzeń medycznych.
Błędy kierownicze
Podczas gdy nadzór regulacyjny może pomóc w ograniczeniu wadliwych produktów wymagających wycofania, innym ważnym wymiarem zjawiska wycofania są menedżerowie, którzy decydują się na wycofanie produktu.
Co ciekawe, prawie wszystkie wycofania produktów medycznych są dobrowolnie wydawane przez firmy, a nie nakazane przez FDA. Dobrowolny charakter tych wycofań daje menedżerom wysoki poziom dyskrecji przy podejmowaniu decyzji o wycofaniu.
Pracowałem z Shah i Karen Donohue na Uniwersytecie Minnesota do badaj uprzedzenia menedżerskie w decyzjach dotyczących wycofania podejmowanych przez prawdziwych menedżerów branży.
Jeden błąd dotyczy lekarzy, którzy kupują wyroby medyczne w imieniu pacjentów. Jeśli menedżerowie wiedzą, że ich klienci, lekarze, prawdopodobnie wykryją wadę urządzenia przed użyciem produktu na pacjencie, menedżerowie zaskakująco rzadziej przypominają sobie. Nieświadomie ufają lekarzowi, że wykryje wykrywalne defekty, eliminując potrzebę wycofania.
To nastawienie było nieznane menedżerom, którzy wzięli udział w tym badaniu. Firmy, z którymi współpracowaliśmy, wykorzystały te wyniki do szkolenia decydentów, aby byli świadomi tego niepożądanego uprzedzenia.
W tym samym badaniu przeprowadziliśmy behawioralny test poznania na menedżerów, zanim podjęli decyzję o wycofaniu. Ten test składający się z trzech pytań mierzy, czy dana osoba podejmuje decyzje w oparciu o intuicję lub refleksję.
Ten test bardzo wyjaśniał, w jaki sposób kierownik podjął decyzję o wycofaniu. Menedżerowie refleksyjni przypominają sobie znacznie rzadziej, ponieważ mogą skłaniać się ku „paraliżowi analitycznemu”, szukając nadmiernych ilości danych, zanim zdecydują się przypomnieć sobie. To może wyjaśniać, dlaczego w środowiskach, w których rozważni menedżerowie podejmują decyzje o wycofaniu, firmy wydają się opóźniać wycofanie, nawet jeśli naraża to klientów na zwiększone ryzyko szkody.
 Lekarze czasami wychwytują defekt urządzenia na wczesnym etapie, zanim zostanie on użyty u pacjenta. Petera Porriniego/shutterstock.com
Lekarze czasami wychwytują defekt urządzenia na wczesnym etapie, zanim zostanie on użyty u pacjenta. Petera Porriniego/shutterstock.com
Inne przyczyny
Kilku różnych współautorów i ja prowadzimy inne ekscytujące badania dotyczące przypominania sobie, które mają na celu kontynuowanie analizy tego ważnego problemu, szczególnie z perspektywy uprzedzeń menedżerskich.
Na przykład w jednym z dokumentów roboczych stwierdzono, że firmy zajmujące się produktami medycznymi, których zarządy mają co najmniej jedną kobietę w zarządzie, podejmują decyzje o wycofaniu produktów znacznie skuteczniej i szybciej niż firmy, w których zarządach są wyłącznie mężczyźni.
W innym dokumencie roboczym stwierdzono, że nowi prezesi w firmach produkujących produkty konsumenckie wydają się kozłem ofiarnym z poprzedniego prezesa. Nowi dyrektorzy generalni mają tendencję do ogłaszania kilku wycofań na początku swojej kadencji, kiedy poprzedni dyrektor generalny jest prawdopodobnie obwiniany za problemy z jakością produktu.
Ponieważ wycofywanie produktów jest wszechobecne i często wiąże się ze szkodami dla konsumentów, mam szczerą nadzieję, że rygorystyczne badania będą nadal odkrywać tę złożoną zagadkę, aby pomóc firmom, organom regulacyjnym i konsumentom.![]()
O autorze
George Ball, adiunkt ds. operacji i technologii decyzyjnych, Kelley School of Business, Indiana University
Artykuł został opublikowany ponownie Konwersacje na licencji Creative Commons. Przeczytać oryginalny artykuł.
Powiązane książki
at Rynek wewnętrzny i Amazon
























