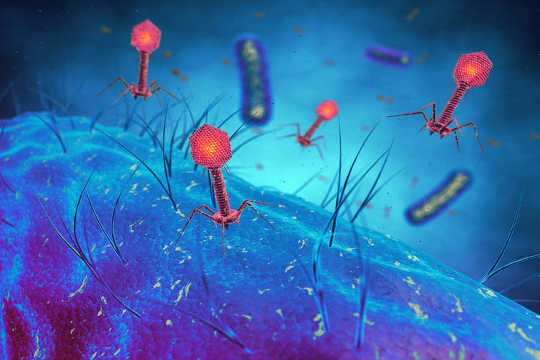
 Wirusy bakteriofagowe infekujące komórki bakteryjne, Wirusy bakteryjne. z www.shutterstock.com
Wirusy bakteriofagowe infekujące komórki bakteryjne, Wirusy bakteryjne. z www.shutterstock.com
Dziś społeczność naukowa jest przerażona perspektywą edycji genów w celu stworzenia „projektanci” ludzie. Edycja genów może mieć większe znaczenie niż zmiana klimatu, a nawet konsekwencje uwolnienia energii atomu.
CRISPR jest akronimem od Clustered Regularly Interspaced Short Palindromic Repeats. Jest to układ odpornościowy, który bakterie wykształciły w celu ochrony przed infekcjami bakteriofagami — najliczniejszą formą życia na planecie.
Mniejszy niż jakakolwiek znana forma życia
Bakteriofagi zostały odkryte w Paryżu przez Felix d'Hérelle na Instytut Pasteura w 1917 roku. Badał podgrupę pacjentów spontanicznie powracających do zdrowia po czerwonce. D'Hérelle zasugerował, że antydrobnoustroje mniejsze niż jakakolwiek znana forma życia zabiły bakterie u zakażonych pacjentów. Wykazał ostatecznie istnienie tej nowej formy życia i nazwał je bakteriofagami: wirusami atakującymi bakterie.
Bakteriofag był intensywnie badany: jego piękno została ujawniona za pomocą mikroskopu elektronowego i jego genom była pierwszą sekwencjonowaną formą życia.
Reagowanie na atak bakteriofagów
W 2007 roku Rodolphe Barrangou i Philippe Horvath z firmy produkującej żywność Danisco współpracowali z Sylvainem Moineau z Uniwersytetu Laval, aby rozwiązać długotrwały problem w produkcji jogurtów. Zapytali: Dlaczego bakterie niezbędne do produkcji jogurtu i sera były podatne na atak bakteriofagów i jak można temu zapobiec?
Barrangou, Horvath i Moineau wykonali zdumiewające odkrycie że bakterie faktycznie miały układ odpornościowy.
CRISPR: nabyte systemy odporności bakteryjnej.
{youtube}yW0yA3qoH9A{/youtube}
Po początkowym ataku bakteriofagowym niewielka liczba przeżywających bakterii rozpoznałaby DNA nowo atakujących bakteriofagów. Bakterie, które przeżyły, wywołałyby wtedy odpowiedź immunologiczną prowadzącą do śmierci bakteriofagów. Bakterie, które przeżyły atak fagowy, osadziłyby fragment bakteriofagowego DNA w swoim genomie bakteryjnym, aby służył jako „pamięć” infekcji.
Cel i zerwanie
Barrangou, Horvath i Moineau wtedy odkryty jak eliminowano atakujące bakteriofagi. Po rozpoznaniu nowo inwazyjnego bakteriofaga bakteria celowałaby w DNA inwazyjnego bakteriofaga i odcinała go.
Fond de recherche de Québec: CRISPR-Cas9 : Pochodzenie wyłomu | Sylvaina Moineau.
{youtube}Bz0aN5qEkyw{/youtube}
Biolodzy Jennifer Doudna i Emmanuelle Charpentier odkryli dalej że „przewodnicy” wyewoluowały w bakteryjnym układzie odpornościowym. Każdy bakteriofag, którego DNA odpowiada nabytemu fragmentowi pamięci z wcześniejszej infekcji, zostanie rozpoznany i odcięty przez „kierowaną” maszynerię eliminacyjną. Układ odpornościowy bakterii obejmujący fragmenty pamięci DNA bakteriofaga oraz mechanizm odpowiedzi bakterii są znane jako układ CRISPR-Cas9.
Eksploatacja komercyjna następującego odkrycia. Doudna, Charpentier i inni uznali, że ten nowy system biologiczny można wykorzystać do edycji genów w dowolnej formie życia.
Bozeman Science: Co to jest CRISPR?
{youtube}MnYppmstxIs{/youtube}
System CRISPR-Cas9 nie jest pierwszym odkrytym systemem edycji genów. Nieżyjący już biochemik Michael Smith, przebywający na Uniwersytecie Kolumbii Brytyjskiej, otrzymał w 1993 r. Nagrodę Nobla za odkrycie chemicznego sposobu edycji genów o zastosowaniach związanych z rakiem i innymi chorobami.
UBC Science: Dziedzictwo dr Michaela Smitha.
{youtube}khYP1dN5nRg{/youtube}
Bakteriofagi jako potencjalne rozwiązanie
D'Hérelle zaobserwował, że ten sam bakteriofag wyizolowany od pacjentów wyzdrowiających z czerwonki może być użyty do ochrony królików przed śmiertelną infekcją. Przed odkryciem antybiotyków odkrycie d'Hérelle zainspirowało Sinclaira Lewisa przedstawić w swoim badaniu terapię bakteriofagową ludzi Powieść nagrodzona Pulitzerem Arrowsmith.
Jeden z największe kolekcje bakteriofagów na całym świecie jest na Uniwersytecie Laval. Kuratorem jest Sylvain Moineau, a kolekcja nosi imię Felixa d'Hérelle.
Mamy nadzieję, że terapię bakteriofagową można uznać za potencjalne rozwiązanie: odporność na antybiotyki. Jednak wszelkie oczekiwania wobec terapii fagowej są przyćmione przez obecne wykorzystanie korzyści komercyjne systemu CRISPR-Cas9.
Obecnie konsekwencje otwarcia puszki Pandory. Zastosowanie systemu CRISPR-Cas9 do generowania projektantów ludzi poprzez edycję genów „linii zarodkowej” zebranych ludzkich komórek jajowych spowodowałoby trwałe zmiany, które będą kontynuowane przez kolejne pokolenia, a obawy związane z tymi działaniami mogą być porównywalne z konsekwencje wojny nuklearnej i zmian klimatycznych.
Istnieją jednak inne potencjalne zastosowania CRISPR-Cas9 „niezarodkowe”, takie jak edycja genów choroby. Udało się to ostatnio z powodzeniem osiągnąć za dystrofia mięśniowa u psów. Podobny do mitu o Puszce Pandory, pesymizm dotyczący edycji genów „linii zarodkowej” może być równoważony nadzieją na przyszłe korzyści dla ludzkości.
{youtube}lXmHA-XySmk{/youtube}
O autorze
John Bergeron, emerytowany profesor Robert Reford i profesor medycyny w McGill, Uniwersytet McGill. John Bergeron z wdzięcznością uznaje Kathleen Dickson za współautorkę.![]()
Artykuł został opublikowany ponownie Konwersacje na licencji Creative Commons. Przeczytać oryginalny artykuł.
Powiązane książki
at Rynek wewnętrzny i Amazon